题目
 搜题
搜题
 更多“氯碱工业中发生主要反应的离子方程式是:()”相关的问题
更多“氯碱工业中发生主要反应的离子方程式是:()”相关的问题
第1题
| 硅在地壳中的含量较高,硅及其化合物的开发由来已久,在现代生活中有广泛应用。回答下列问题: (1)陶瓷、水泥和玻璃是常用的传统的无机非金属材料,其中生产普通玻璃的主要原料有____。 (2)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
①工业上用石英砂和焦炭在电弧炉中高温加热到1600℃-1800℃除生成粗硅外,也可以生产碳化硅,则在电弧炉内可能发生的反应的化学方程式为____。 ②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,粗硅生成SiHCl3的化学反应方程式____。 (3)有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和____;SiHCl3极易水解,其完全水解的产物为____。
(4)还原炉中发生的化学反应为:____。 (5)氯碱工业可为上述工艺生产提供部分原料,这些原料是____。 |
第2题
A.装置中出口处的物质是氯气
B.出口处的物质是氢气
C.该离子交换膜只能让阳离子通过,不能让阴离子通过
D.装置中发生反应的离子方程式为
第3题
| 氯、溴、碘、钠、镁、锰、锂、铀等元素在海洋中被富集。海洋开发利用和维权是国家战略。 (1)以上元素在海水中的存在形态是___________(选填①游离态②化合态③不确定) (2)以下变化属于化学变化的是__________________________: ① (3)由氯气和晒盐后的卤水制取液溴的离子方程式______________________________;由石灰乳和卤水沉淀出镁元素的离子方程式_____________________________________;由海带灰可浸出KI,由某种矿盐可浸出KIO3,二者在盐酸中反应可生成碘单质,反应的离子方程式__________________________________。 (4)工业由氯化钠制取金属钠的化学方程式为____________________________;工业制镁采用电解熔融氯化镁,不采用电解熔融氧化镁的原因是_______________________ (5)海底富集多种矿物结核,锰结核是其中的一种。锰结核中主要含有MnO2和Fe2O3。一种质量比约为m(Mn):m(Fe)=55:448的合金钢(其它元素略),具有抗御激烈冲击和磨损的能力,可做航母甲板等。欲通过铝热反应炼得这样的合金,MnO2、Fe2O3、Al的投料比(按物质的量之比)约为_______________。 |
第4题
工业上用铝土矿(主要成分为氧化铝,含少量氧化铁)制取铝的过程如图所示: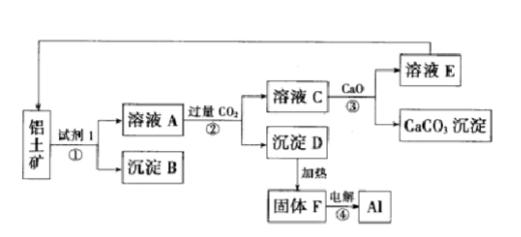 请回答:
请回答:
(1)试剂Ι为()(填化学式),①-④转化中属于氧化还原反应的是()(填序号);
(2)沉淀B的化学式为(),写出该物质发生铝热反应的化学方程式();
(3)电解F,当转移0.6mol,电子时,可制得铝()g;
(4)沉淀D是药物“胃舒平”的主要成分,可用于治疗胃酸(稀盐酸)过多,写出该反应的离子方程式();
(5)②中发生反应的离子方程式为()。
第5题
| (10分)工业上电解制烧碱的技术是用离子交换膜法,主要原料是饱和食盐水。下图为离子交换膜法电解原理示意图:
请回答下列问题: (1)电解槽中部的阳离子交换膜把电解槽隔成了阴极室和阳极室,这种阳离子交换膜,只允许溶液中的__________通过(填写下列微粒的编号),而两边的水不能自由流通。 ①H+② Cl-③Na+④OH- (2)A极为电解槽的________极,电极反应式为__________________________________, (3)如果没有阳离子交换膜,阴阳两极的某两种产物在常温下会在溶液中发生反应而使烧碱不纯,其反应的离子方程式为_______________。 (4)若将标准状况下6.72L的阳极气体通入热的氢氧化钠溶液中,反应中只有一种元素的化合价发生改变,得到了两种含氯化合物,其中还原产物与氧化产物物质的量之比为5:1,写出该反应的离子方程式_____________________________________________。 |
第6题
高铁酸钾是一种高效的多功能的水处理剂。工业上常采用NaClO氧化法生产,原理为:3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O Na2FeO4+2KOH=K2FeO4+2NaOH 主要的生产流程如下: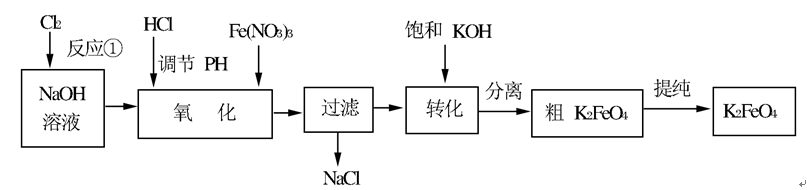 问题一、写出反应①的离子方程式()。
问题一、写出反应①的离子方程式()。
问题二、流程图中“转化”是在某低温下进行的,说明此温度下Ksp(K2FeO4)()Ksp(Na2FeO4)〔填“>”或“<”或“=”〕。
问题三、反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。
图1为不同的温度下,Fe(NO3)3不同质量浓度对生成率的影响;
图2为一定温度下,Fe(NO3)3质量浓度最正确时,NaClO浓度对K2FeO4生成率的影响
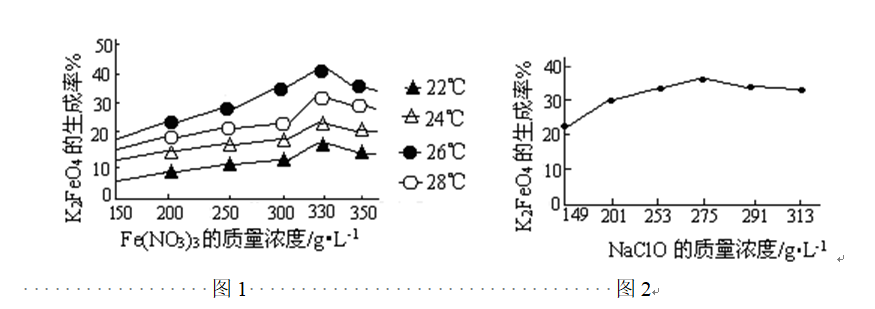
①工业生产中最正确温度为()℃,此时Fe(NO3)3与NaClO两种溶液最正确质量浓度之比为()。
②假设NaClO加入过量,氧化过程中会生成Fe(OH)3,写出该反应的离子方程式:()。假设Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化复原反应生成K3FeO4,此反应的离子方程式:()。
问题四、K2FeO4在水溶液中易水解:
4FeO42—+10H2O 4Fe(OH)3+8OH—+3O2↑。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用溶液()(填序号)。
4Fe(OH)3+8OH—+3O2↑。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用溶液()(填序号)。
AH2O
BCH3COONa、异丙醇
CNH4Cl、异丙醇
DFe(NO3)3、异丙醇
第7题
A.氯碱工业中,离子交换膜的作用是防止离子运动
B.硫酸、硝酸、合成氨均使用了催化剂
C.石油裂化的主要目的是得到更多的乙烯、丙烯等气态短链烃
D.氯气和氢气混合在光照条件下生成氯化氢,用水吸收得到盐酸
第9题
A.向硫酸铜溶液中加入NaHS溶液:Cu2++HS-===CuS↓+H+
B.用醋酸除去水垢中的碳酸钙:CaCO3+2H+===Ca2++H2O+CO2↑
C.用强碱溶液吸收制取硝酸的工业尾气:NO+NO2+2OH-===2NO+H2O
D.将少量SO2气体通入氨水中:SO2+NH3·H2O===NH+HSO
第10题
利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下:其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+,Al3+,Ca2+,Mg2+。
(1)实验室用18.4mol·L的浓硫酸配制480mL4.6mol·L的硫酸,需量取浓硫酸()mL,配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需()。
(2)酸浸时,为了提高浸取率可采取的措施有()。答出两点。
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式()。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下: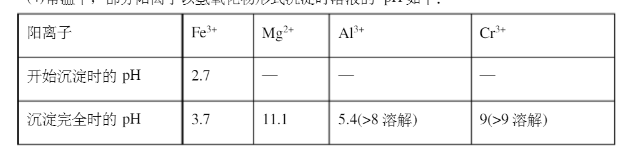 加入NaOH溶液使溶液呈碱性,既可以除去某些杂质离子,同时使Cr2O72-转化为CrO42-,但溶液的PH不能超过8,其理由是用离子方程式表示()。
加入NaOH溶液使溶液呈碱性,既可以除去某些杂质离子,同时使Cr2O72-转化为CrO42-,但溶液的PH不能超过8,其理由是用离子方程式表示()。
(5)钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是()。
(6)写出上述流程中用SO2进行还原时发生反应的化学方程式:()。
第11题
从铝+矿(主要成分是Al2O3,含RO2、Fe2O3等杂质)中提取Al2O3的一种工艺流程如图13所示: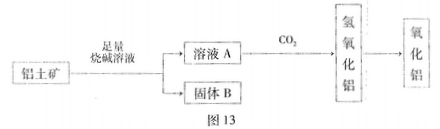
问题一、元素R位于周期表中的第三周期,其最高正化合价和负化合价的绝对值相等。RO2的用途有(写出1条即可)()。
问题二、铝土矿加入足量烧碱溶液后主要反应的离子方程式为
①()。
②()。
问题三、工业上通过电解氧化铝和冰晶石的熔融液来冶炼金属铝。已知电极材料为惰性材料,阳极反应式为()。
问题四、氧化铝与焦炭的混合物在氮气中高温加热反应,制得新型非金属材料AIN与一种中学常见气体X。已知每转移3mole-,有1.5mol化合物X生成,此反应的化学方程式()。

 警告:系统检测到您的账号存在安全风险
警告:系统检测到您的账号存在安全风险
为了保护您的账号安全,请在“赏学吧”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!
